Le règlement 2017/746 relatif aux dispositifs médicaux de diagnostic in vitro (IVDR) est entré en vigueur le 26 mai 2022 abrogeant ainsi l'ancienne directive IVD 98/79/CE. Les fabricants et fournisseurs du secteur font toujours face à de nombreux obstacles et zones d'ombre. Vous avez besoin de clarté? Rendez-vous le 24 novembre!
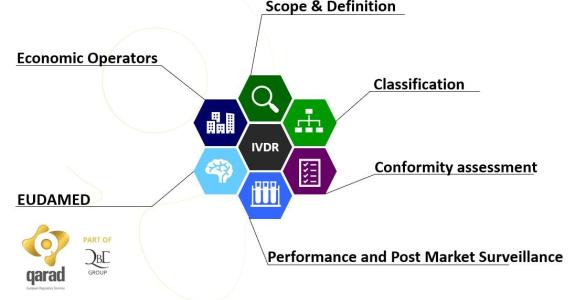
Qu'entend-on par 'dispositif médical de diagnostic in-vitro' ? Le terme désigne tout dispositif médical qui consiste en un réactif, un produit réactif, un matériau d'étalonnage, un matériau de contrôle, une trousse, un instrument, un appareil, un équipement, un logiciel ou un système, utilisé seul ou en association, destiné par le fabricant à être utilisé in vitro dans l'examen d'échantillons provenant du corps humain, y compris les dons de sang et de tissus, uniquement ou principalement dans le but de fournir des informations sur l'état et les réactions du corps humain, faire des prévisions sur ceux-ci ou les surveiller.
Cette nouvelle réglementation IVDR établit les règles concernant la mise sur le marché, la mise à disposition sur le marché et la mise en service de dispositifs médicaux de diagnostic in vitro à usage humain et d'accessoires pour ces dispositifs au sein de l'Union européenne. Le règlement s'applique également aux études de performance sur ces dispositifs et leurs accessoires menées dans l'UE.
Session d'information en coopération avec Qarad
Dans le cadre de la prochaine réunion du groupe de supervision du projet COOCK Medical diagnostics goes micro and smart, un séminaire sera organisé par une des entreprises membres. Qarad (groupe QbD) est spécialisée dans les questions de réglementation et les systèmes de qualité pour le secteur des dispositifs médicaux de diagnostic in vitro, et nous donnera des éclaircissements sur le nouveau règlement IVDR. Au cours de ce séminaire, nous nous concentrerons sur l'application du règlement sur les puces microfluidiques et sur leurs dispositifs de conditionnement et de lecture destinés aux tests de diagnostic. Un expert de Qarad dans le domaine des dispositifs médicaux de diagnostic in vitro fera le point sur ces réglementations. Les participants auront l'occasion de poser des questions relatives à leur projet ou situation.
Vous voulez participer à cette séance d'information, que nous organiserons le 24 novembre, de 11 à 13 heures sur notre site de Louvain? Plus d'information et inscriptions via le lien suivant!